慢加急性肝衰竭主题月评—8月刊:肝性脑病研究进展
—— 作者: 时间:2019-08-30
阅读数:
329

前言
“慢加急性肝衰竭(ACLF)主题月评”是中国慢(加急)性肝衰竭联盟受《国际肝病》编辑部邀请,制作的ACLF相关学术月评专栏。本专栏每月以ACLF某一特定领域为主题展开,旨在普及ACLF的概念及意义、帮助读者快速了解有关领域的进展。希望本专栏对无论是需要了解相关领域热点的肝病专家及研究人员,或是需要实用知识、活跃于临床一线的医务工作者,均能有所裨益。
本期简要阐述了肝性脑病(HE)的发病机制、诊断及治疗的研究进展,并检索了本月(2019.07.20~2019.08.20)在线发表的HE相关重要文献并附简评。
微信图片_20190428105657.png
关于作者:
中国慢(加急)性肝衰竭联盟(Chinese Acute-on-chronic liver failure Consortium,Ch-CLIF-C)是由上海交通大学附属仁济医院消化内科李海教授牵头,由全国14家三甲医院感染科/肝病中心共同参与成立的肝病科研合作团队,致力于探索慢加急性肝衰竭(ACLF)的发病机制、制定基于高循证等级的HBV高流行区ACLF诊断标准。目前团队开展了全球已报道入组数最多的ACLF前瞻性多中心队列研究“CATCH LIFE”(Chinese AcuTe-on-CHronic LIver FailurE),包含2个大型队列(入组2600例的探索队列与入组1385例的验证队列)。
黄燕,医学博士,教授,主任医师,硕士研究生导师。现为中南大学湘雅医院传染病教研室主任,感染病科副主任(主持工作),中华医学会肝病学分会委员,中华医学会感染病学分会委员,中国医师协会感染科医师分会委员,湖南省医学会肝病学分会副主任委员,湖南省医学会感染病学分会副主任委员。擅长疑难和重症肝病的诊断和治疗。2009年11月~2010年12月赴美国纽约大学医学院北岸医院急诊医学实验室工作一年,从事脓毒症发病机制的相关研究。主持国家自然科学基金课题2项,省级课题3项。参与4项国家自然科学基金课题、4项国家重大科技项目和多项省部级课题。获湖南省科技进步二等奖2项。已发表相关专业论文40余篇。参编医学专著6部。
→
主题评述
肝性脑病(HE)是由急性或慢性肝损伤引起的复杂的神经精神病综合征。为了促进HE临床诊疗的规范化,美国胃肠病学会(AGA)实践标准委员会、国际HE和氮代谢学会(ISHEN)、美国肝病学会(AASLD)和欧洲肝病学会(EASL)等先后制定了多部指南或共识,从HE的发病机制、自然史、流行病学、诊断评价和治疗等方面提出了推荐意见。
壹
HE的发病机制
HE是急性或慢性肝损伤患者中发生的以代谢紊乱为基础的神经精神异常综合征,从亚临床改变到昏迷,可表现为可逆的代谢脑病、脑水肿等。
HE的发病机制多种,包括氨中毒学说、γ-氨基丁酸(GABA)/苯二氮卓(BZ)复合受体学说、假性神经递质学说等[1, 2]。氨中毒目前仍是HE主要的发病机制学说:肝衰竭时肝脏对氨的代谢能力明显减退;出现门-体分流时,肠道的氨不经肝脏代谢而直接进入体循环,血氨升高,高氨血症时大脑中星形胶质细胞迅速将血氨转化为谷氨酰胺,一方面消耗大量ATP,使大脑细胞的能量供应不足,另一方面细胞内谷氨酰胺浓度升高可提升胞内渗透压,进而导致细胞水肿[1]。传统观点认为大脑内血氨的作用是增加氧化应激、渗透压以及随后的星形胶质细胞肿胀,然而最近研究表明,血氨也对许多信号转导通路、基因表达和转录后蛋白修饰有影响,共同导致星形胶质细胞功能受损,表现为异常增殖、神经递质释放甚至是细胞凋亡[3-5]。
同时有研究表明氧化应激、活性氧的生成和氮的种类均与HE有关,线粒体功能受损和关键抗氧化酶的表达下调均会增加细胞膜脂质、蛋白质和DNA的氧化损伤,研究强调了氧化损伤在肝性脑病发病机制中的重要性,尤其值得注意的是Boris等对高氨血症啮齿动物模型进行谷胱甘肽抑制剂治疗后发现,氧化应激与高氨血症间的协同作用是导致HE发生脑水肿的必要条件[3-5]。
Glymphatic系统是新发现的一种可以清除由于其活动而积聚在大脑中的各种物质的全脑通路,有研究评估了该系统的功能是否在肝硬化发生的脑功能障碍模型中发生了改变,研究表明在HE时由于glymphatic系统回流障碍,减少了肝硬化大脑物质的清除率,进一步导致肝性脑病的发生[6]。
目前越来越多的研究表明肝性脑病是多种机制协同作用的结果,这对今后早期预防、及时诊断和有效治疗具有重要的意义[2, 7] 。
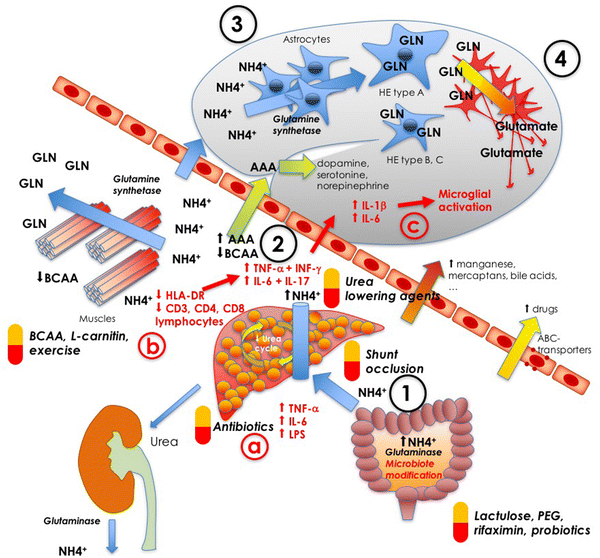
HE发病机制示意图[1]
贰
HE的诊断
AASLD建议应根据基础疾病、诱因以及时间等对HE进行分类诊断,在2014年AASLD的指南中指出每一个临床疑似肝性脑病的患者都应进行分类诊断,如表1。
表1.HE分类诊断

HE诊断的金标准来自于West Haven诊断标准,AASLD指出在利用该标准诊断时具有一定的主观诊断缺陷,尤其是在诊断HE一期不能准确判断患者分级,因此通常同时利用哥斯拉昏迷量表进行评估,这为确切诊断HE提供了有效的诊断途径。CT和MRI通常可作为首次检查HE的手段,排除其他病理可能性;血氨的检测必不可少;对于认知功能的诊断,ISHEN建议医生至少采用两个方法去检测患者认知功能,对于轻微型HE(MHE)和隐匿型HE(CHE)的检测也很重要,如利用PHES、CRT、ICT、SCAN、Stroop、CFF、EEG等方法检测MHE和显性肝性脑病(OHE),其能有效地预测OHE的发展,在检测的同时也应注意排除其他引起精神性因素异常的可能性,如神经药物治疗、酒精等[2, 8]。
表2.West Haven 诊断标准和临床描述

叁
HE的治疗
去除HE发作的诱因是治疗的首要方法。
使用乳果糖或乳糖来减少肠腔中氨的吸收是管理HE的初始方法,其减少肠道氨的产生。研究表明正常的蛋白质摄入似乎不会加剧HE,并建议乳糖素剂量为25 mL每日两次作为一线药剂,每天调整三次排便量;通过静脉注射L-鸟氨酸-L-门冬氨酸为尿素循环提供替代底物来降低氨的水平;对于肝硬化患者的复发性HE,将改变肠道微生物群的利福昔明(每天两次550 mg)加入乳果糖中。这种联合治疗可以减少住院的频率,延长新发病的时间。
同时采用一般和对症治疗,如预防脑水肿等。
对于标准治疗没有反应的HE和肝硬化患者,考虑大型门体分流术。
终末期肝病可作为肝移植的指征,一旦患者出现主要指标并发症(例如腹水、HE或静脉曲张出血)或MELD评分高于15,则考虑进行移植[8, 9]。
作者:裴思雅 黄燕
近1月ACLF的研究统计及简评
2019.07.20~2019.08.20期间,PubMed上发表HE相关的综述和论著共计31篇,涉及诊断、病因、治疗以及预测预后等各个方向,具体数据见下图:

图.2019.7.20-2019.8.20于PubMed上检索到的ACLF相关文章分布
1
Short-Term Proton Pump Inhibitor Use and Hepatic Encephalopathy Risk in Patients with Decompensated Cirrhosis.(J Clin Med.) (2019 Jul 25)DOI:10.3390/jcm8081108.IF=5.68(病因与治疗)
简述:该文介绍了一项评估质子泵抑制剂(PPI)使用者发生肝性脑病(HE)风险的研究。通常使用PPI的窗口期约3~6个月,然而,短期PPI暴露后的HE风险仍不明朗。研究者使用病例交叉研究设计,探讨了短期PPI暴露的影响。研究者从国家健康保险研究数据库中检索出接受过HE诊断的失代偿期肝硬化患者的记录。比较病例和对照的PPI使用率来确定PPI使用与HE风险之间的关联。
文献分析了13 195名患者PPI暴露后的HE风险,除奥美拉唑和泮托拉唑外,所有PPI类别均与HE风险增加有关。不考虑其他促发因素,如近期胃肠道出血或感染,PPI显著增加HE风险,短期PPI的使用与失代偿期肝硬化患者的HE显著相关。因此,医生在这些患者中使用PPI时应进行适当的调整,并在短期使用PPI后仔细监测HE的体征。
简评:该研究着眼于评估暴露于PPI后的HE风险,结果显示除奥美拉唑和泮托拉唑外,使用其他PPI均与HE风险增加相关,这提示医生在使用PPI时应严格注意患者适应证,且在使用PPI后应严密监测HE体征。
2
Ameliorative effect of Magnesium Isoglycyrrhizinate on hepatic encephalopathy by Epirubicin.(Int Immunopharmacol.)( 2019 Jul 24)DOI:10.1016/j.intimp.2019.105774. IF=3.361(发病机制)
简述:本研究评估异甘草酸镁(MI)对表阿霉素(EPI)诱导的肝性脑病(HE)的保护作用,并探讨其潜在机制,通过诱导小鼠HE检测HE相关指标,实验表明其潜在的机制可能与通过Txnip / Nrf2 / NF-κB途径的抗炎、抗氧化和抗凋亡特性有关。
简评:通过小鼠造模HE模型,研究者发现了MI对HE的保护作用的潜在机制,下一步应探索其临床证据。
3
Real-world effects of long-term rifaximin treatment for Japanese patients with hepatic encephalopathy.(Hepatol Res.)(2019 Jul 26.)DOI: 10.1111/hepr.13415. IF=3.44(治疗)
简述:由于胃肠道微生物组可能因种族而异,所以利福昔明(RFX)在日本HE患者中的安全性和有效性可能与之前的来自美洲或欧洲的报道不同。本文研究了RFX长期治疗对HE的安全性和效果,此外还调查了与RFX治疗后HE复发相关的因素。
结果表明,RFX的长期治疗有利于改善患者的HE和肝功能,且在没有腹水的RFX治疗患者中,HE的复发率低。因此,RFX的长期治疗可能对日本HE患者有益。
简评:RFX于2016年在日本获得批准,患者治疗12周后的安全性和有效性明确,但长期治疗的益处知之甚少。由于胃肠道微生物组可能因种族而异,本文为RFX长期治疗对日本HE患者的安全性和有效性提供了依据。
4
Beneficial effects of L-ornithine L-aspartate for prevention of overt hepatic encephalopathy in patients with cirrhosis: a systematic review with meta-analysis.(Metab Brain Dis.)(2019 Jul 23. )DOI:10.1007/s11011-019-00463-8.IF=2.411(治疗与预防)
简述:本研究采用荟萃分析对L-鸟氨酸L-天冬氨酸(LOLA)可预防肝硬化患者发生OHE的证据基础进行了验证。根据Jadad-Cochrane标准建立纳入/排除标准,对来自6项随机对照试验(RCT)的共计384名患者数据进行分析,其中5项RCT具有高质量和低偏倚风险。
结果表明,OHE的成功预防伴随着血氨的显著降低。口服和静脉注射LOLA制剂可有效预防轻微(minimal)HE患者进展为OHE,这些研究结果提供了LOLA在预防肝硬化OHE方面的直接证据。
简评:该研究表明在预防肝硬化患者发生肝性脑病方面,LOLA有预防OHE发生的潜在优点,给出了LOLA预防OHE的首个直接证据,当然还需要进一步的研究进行验证。
5
Associated vitamin D deficiency is a risk factor for the complication of HCV-related liver cirrhosis including hepatic encephalopathy and spontaneous bacterial peritonitis.(Intern Emerg Med.) (2019 Aug)DOI: 10.1007/s11739-019-02042-2. IF=2.335(诊断与预测)
简述:该研究前瞻性调查了维生素D缺乏与丙型肝炎相关肝硬化患者自发性腹膜炎(SBP)/HE风险之间的关系,包括死亡率。结果共纳入135名患者,其中45例出现HE,45例出现SBP,另有45例无并发症的肝硬化患者作为对照组。维生素D缺乏被定义为25(OH)D水平<20 ng/mL。
结果表明,HE和SBP组血清25(OH)D水平显著低于对照组。ROC曲线显示,低于7.1 ng/mL和6.6 ng/mL的较低25(OH)D水平可分别预测SBP和HE患者的死亡率,具有高灵敏度和特异性;血清25(OH)D水平<5 ng/mL与更高的死亡率相关(HR:2.76)。
简评:细菌感染影响肝硬化患者的存活率,是导致死亡的主要原因。较低的25(OH)D水平与肝硬化患者的HE和SBP相关,因此,维生素D水平有望作为肝硬化严重程度的预后参数。但这项研究是单中心的,需要更多研究进一步证实。
参考文献:(可上下滑动查看)
[1].Weiss, N., R. Jalan and D. Thabut, Understanding hepatic encephalopathy. Intensive Care Med, 2018. 44(2): p. 231-234.
[2].Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the European Association for the Study of the Liver and the American Association for the Study of Liver Diseases. J Hepatol, 2014. 61(3): p. 642-59.
[3].Gorg, B., et al., O-GlcNAcylation-dependent upregulation of HO1 triggers ammonia-induced oxidative stress and senescence in hepatic encephalopathy. J Hepatol, 2019.
[4].Rackayova, V., et al., (1)H and (31)P magnetic resonance spectroscopy in a rat model of chronic hepatic encephalopathy: in vivo longitudinal measurements of brain energy metabolism. Metab Brain Dis, 2016. 31(6): p. 1303-1314.
[5].Haack, N., P. Dublin and C.R. Rose, Dysbalance of astrocyte calcium under hyperammonemic conditions. PLoS One, 2014. 9(8): p. e105832.
[6].Gallina, P., et al., A hydrodynamic hypothesis for the pathogenesis of glymphatic system impairment in hepatic encephalopathy. J Hepatol, 2019. 71(1): p. 228-229.
[7].Ferenci, P., Hepatic encephalopathy. Gastroenterol Rep (Oxf), 2017. 5(2): p. 138-147.
[8].Cordoba, J., et al., Characteristics, risk factors, and mortality of cirrhotic patients hospitalized for hepatic encephalopathy with and without acute-on-chronic liver failure (ACLF). J Hepatol, 2014. 60(2): p. 275-81.
[9].Wijdicks, E.F., Hepatic Encephalopathy. N Engl J Med, 2016. 375(17): p. 1660-1670.
作者:裴思雅 黄燕
标签:
述评/点评
肝性脑病
发表评论
全部评论
