盘点丨2018年NAFLD研究进展中国贡献
—— 作者: 时间:2019-01-25
阅读数:
582
邵幼林 江苏省常州市第三人民医院肝病科暨脂肪肝中心
范建高 上海交通大学医学院附属新华医院消化内科暨脂肪肝中心
编者按:目前,全球25%的人患有非酒精性脂肪性肝病(NAFLD),NAFLD已发展为全球最常见的慢性肝病。由于城市化和老龄化,未来十多年内NAFLD,特别是非酒精性肝炎(NASH)患病率将进一步增加[1]。因此NAFLD成为全球研究热点,国内外发表了众多高质量NAFLD文章(表1)。现对一年来中国研究者进行和参与的重要研究做一盘点。
2018年PubMed收录的NAFLD文献数量
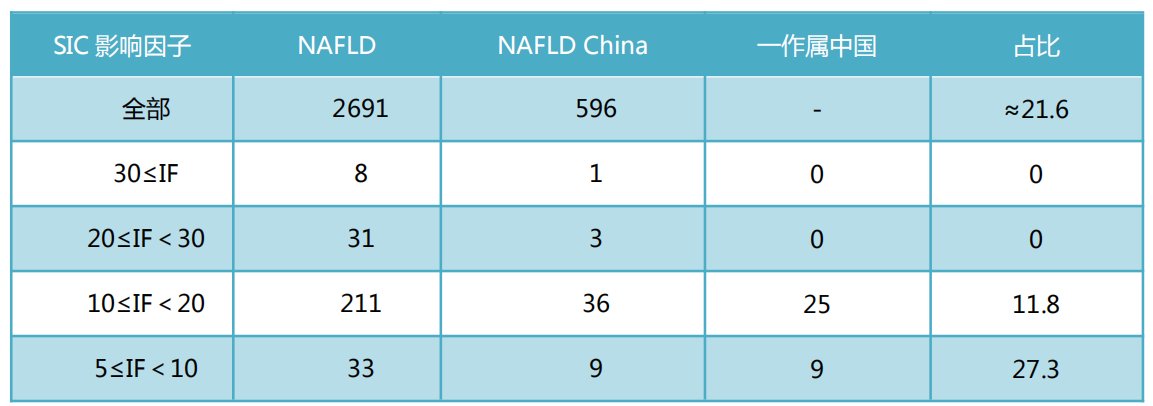
注:以NAFLD,NAFLD China检索的结果(2019-01-14 15:00)
01
NAFLD流行病学与临床研究
基于成人肥胖和2型糖尿病(T2DM)患病率的数据,使用模型估计中美等8个国家的NAFLD和NASH疾病进展。如果将来肥胖和T2DM水平发病率不变,2016-2030年期间NAFLD总数将略有增长,然而,NASH患病率将增加15%~56%。由于人口增加和老龄化,NAFLD相关晚期肝病和肝病死亡率将增加1倍以上,由于快速城市化的原因,中国NAFLD增长率最高[2]。
一项对50万中国成人的前瞻性研究发现,与非糖尿病患者相比,糖尿病患者肝癌、肝硬化和NAFLD的HR值分别为1.49、1.81和1.76[3]。在一项进展期NASH多国队列研究中,F3纤维化患者较Child-Turcotte-Pugh评分5分和6分的NAFLD肝硬化患者非肝移植10年生存率更高,分别为94%、74%和17%。NAFLD肝硬化患者疾病不良预后主要与肝病进展相关,而桥接纤维化患者主要与非肝脏肿瘤和心血管事件相关[4]。
已有较多研究显示地中海饮食与较低的NAFLD风险相关。一项对山东临沂青少年膳食结构调查显示,中国传统饮食模式与较低NAFLD风险相关,而西方饮食模式与较高NAFLD风险相关[5]。生活方式干预12个月,非肥胖(亚洲标准)NAFLD和肥胖NAFLD患者需体重减轻3%~5%和7%~10%达到相同效果,实现一半患者NAFLD缓解,且从长远(6年)来看,非肥胖NAFLD患者比肥胖NAFLD患者更有可能维持体重减轻和肝酶正常[6]。
Yan等将75名伴二甲双胍血糖控制不佳T2DM的NAFLD患者随机分组(1:1:1),分别额外给予利拉鲁肽、西格列汀或甘精胰岛素治疗26周,发现除了改善血糖,二甲双胍联合利拉鲁肽和西格列汀还可以降低体重,MRI-PDFF定量的肝内脂肪和内脏脂肪面积[7]。
02
NAFLD基础研究
NAFLD发生和发展的机制涉及如糖脂代谢、炎症、氧化应激、纤维化、肠菌及代销产物、免疫、癌变等。2018年中国科学家在这些发病机制中进行了广泛研究。
2.1信号通路仍是深入研究NAFLD机制的主要方向
(1)磷酸化
双特异性磷酸酶(DUSP)是一类既可使酪氨酸残基脱磷酸,又可使丝氨酸/苏氨酸残基脱磷酸的酶蛋白,在促分裂原活化的蛋白激酶信号途径对多种信号分子的介导中起不可替代的作用。
Wang等通过肝特异性基因敲除小鼠研究了研究DUSP14,显示DUSP14直接结合并去磷酸化TAK1,并下调其下游信号分子JNK/p38和NF-κB,改善NAFLD[8]。
Ye等采用相近的方法研究了DUSP26[9]和DUSP9[10]在肝脂肪变、肝纤维化众多信号通路,发现DUSP 26 与DUSP14机制相似,其与TAK1的结合阻断TAK1的磷酸化来调节JNK/p38信号轴以减轻肝脏脂肪变性和代谢紊乱[9];而DUSP9通过阻断ASK1磷酸化和随后的JNK/p38信号传导的激活来减轻NAFL和NASH进展[10]。
腺病毒介导肝脏过表达Caspase募集结构域蛋白6 ob/ob小鼠亦通过抑制ASK1及随后的下游JNK/p38信号改善IR和肝脂肪变[11]。
3-巯基丙酮酸硫基转移酶(MPST)是调节内源性硫化氢(H2S)生物合成的关键酶,FFA上调肝脏表达的MPST抑制H2S产生,并上调随后的SREBP 1c、JNK磷酸化和氧化应激来促进脂肪变性[12]。
肝细胞特异性肿瘤进展基因座2(TPL2)是一种丝氨酸/酪氨酸激酶,TPL2敲除小鼠表现出改善高脂喂养导致的糖脂代谢失衡、IR和肝脏炎症。TPL2通过特异性底物MKK7激活JNK增强了小鼠的肝脏和全身代谢紊乱[13]。
表皮生长因子受体(EGFR)是一种酪氨酸激酶型受体, NAFLD小鼠模型肝组织中EGFR被磷酸化,抑制EGFR可以防止饮食诱导的脂质积聚、氧化应激和HSC活化以及基质沉积[14]。
(2)泛素化
肝细胞泛素特异性蛋白酶(USP)参与环境应激反应、肿瘤生长、炎症和细胞代谢、细胞信号转导等。USP4耗竭加剧了HFD诱导NAFLD小鼠的肝脂肪变性、IR和炎症反应。肝细胞USP4直接结合并去泛素化TAK1,导致下游NF-κB和JNK级联反应的抑制,从而逆转IRS-AKT-GSK3β的破坏,改善NAFLD[15]。USP10通过与Sirt6相互作用并抑制其泛素化和降解来调节肝脂肪变性,Sirt6过表达显著改善了USP10缺乏对肝脂肪变性、IR和炎症的影响[16]。
白细胞免疫球蛋白样受体B4(LILRB4)募集SHP1以抑制肿瘤坏死因子受体相关因子(TRAF6)泛素化,导致下游NF-κB与p38失活,从而避免HFD诱导的IR、葡萄糖代谢失衡、肝脏脂质积累和小鼠的系统性炎症[17]。特异性肿瘤坏死因子受体相关普遍存在的支架和信号蛋白(TRUSS)与IκBα相互作用并促进IκBα的泛素化和降解,导致NF-κB异常激活而促进NAFLD和代谢紊乱[18]。
2.2从免疫角度研究NAFLD脂肪变、炎症和纤维化
破坏巨噬细胞和肝细胞中的腺苷2A受体都会导致炎症加重、SREBP1c表达增强,最终导致NAFLD变得更加严重[19]。巨噬细胞的跨膜蛋白173(STING)信号传导激活I型干扰素介导的先天免疫应答。Luo等研究显示NAFLD患者和小鼠模式动物肝组织中STING水平增加。在小鼠中,敲除巨噬细胞中STING降低了肝纤维化和炎症反应的严重性,提示先天免疫反应与肝脏脂肪变性和NAFLD有关[20]。
饮食诱导的NAFLD引起肝细胞中NR4A1的上调,导致DNA-PKcs和p53的活化。p53驱动线粒体裂变和自噬停滞,介导线粒体功能障碍。补充褪黑激素通过阻断NR4A1/DNA-PKcs/p53途径阻止线粒体裂变并恢复线粒体自噬,可以有效减少NAFLD对肝脏和线粒体结构和功能的损害[21]。
2.3从基因角度研究NAFLD脂肪变、炎症、纤维化和癌变
超保守(uc)RNA是一类长链非编码RNA(lncRNA)。uc372抑制miR-195/miR-4668成熟,以调节合成和摄取脂质相关的基因表达,从而促进脂质生成,肝脏脂肪累积[22]。
长链非编码RNA Blnc1在肥胖NAFLD小鼠的肝脏表达强烈升高。Blnc1是响应LXR活化诱导SREBP1c和肝脂肪生成基因所必需[23]。
Zhang等发现饮食肥胖小鼠和NASH患者的肝脏中MiR-378表达增加,miR-378直接靶向编码AMP激活的蛋白激酶γ2(AMPKγ2)的Prkag2,并通过正向调节NF-κB-TNFα轴在肝脏炎症和纤维化的发展中起关键作用[24]。他们的另一篇报道显示,microRNA-378位于过氧化物酶体增殖物激活受体γ共激活因子1-β(Ppargc1β)的内含子内,LXRα为microRNA-378的转录激活因子和Ppargc1β转录的阻遏物,通过它们协同造成肝损伤[25]。
高甘油三酯非高胆固醇喂养小鼠出现了单纯肝脂肪变,而高甘油三酯高胆固醇喂养小鼠则发展为NASH。且在二乙基亚硝胺处理的小鼠中喂养胆固醇较非胆固醇诱导的NASH-HCC更大和更多。与脂肪变-HCC相比,NASH-HCC显示出更多的异常信号通路基因表达富集,结果提示膳食胆固醇通过失调的代谢和钙信号传导促进NASH-HCC[26]。香港学者通过NAFLD-HCC样品的RNA测序分析显示角鲨烯环氧酶(SQLE)是NAFLD-HCC患者中过表达的最高异常代谢基因。小鼠中肝细胞特异性Sqle转基因表达加速高脂高胆固醇饮食诱导的HCC的发生。SQLE通过其代谢物胆固醇酯和NADP +发挥其致癌作用[27]。
2.4 从肠菌及其代谢产物角度研究NAFLD
肠道微生物及其代谢物可能通过改变肠道通透性、细菌产物易位、相关信号通路在NAFLD的发展中起着更重要的作用。周达等研究显示NAFLD患者的血清GLP-1水平与正常对照组相似,但在NAFLD患者中肝脏GLP-1R表达显著下调。肠道代谢物丁酸钠能够通过促进肝GLP-1R表达来阻止NAFL进展为NASH [28]。
Sirtuin 3(SIRT3)通过改善肝线粒体功能障碍对NAFLD起保护作用。HFD的SIRT3敲除小鼠出现肠道微生物生态失调、肠道通透性和炎症损伤,提示SIRT3缺乏通过肠道微生物群失调促进NAFLD进展与肠道通透性受损相关[29]。
NAFLD患者血清中初级胆汁酸和次级胆汁酸绝对浓度增加,其中次级胆汁酸DCA(FXR拮抗剂)的相对含量显著增加,而初级胆汁酸CDCA(FXR激动剂)的相对含量显著降低。NAFLD患者胆汁酸变化与肠道微生物组的组成改变有关。结果表明可以通过靶向调控FXR信号介入NAFLD的治疗[30]。
2.5其他
胰岛素通路分为经典(促脂肪生成)和非经典(Snail1抗脂肪生成)通路,Snail1通路受损可能导致肥胖者发生NAFLD[31]。NAFLD患者肝催乳素受体基因表达显著降低,且病情越严重下降越明显[32]。另外,中药治疗NAFLD的机制研究众多,如水飞蓟素、斛皮素、白藜芦醇、柴胡、生姜等,深入的、高质量的研究将为中药治疗NALFD提供理论支持。
总之,近年来中国发表的文章逐年增多,文章质量逐年提高,祖国东西南北各区域全面进步,限于篇幅限制难以全面呈现。希望在新的一年中,有更多属于中国学者的更重量级的成果发表,让我们不再是跟随欧美,而能够比肩欧美、甚至有一天领先欧美。
参考文献
[1] Younossi Z, Tacke F, Arrese M, et al. Global Perspectives on Non-alcoholic Fatty Liver Disease and Non-alcoholic Steatohepatitis[J]. Hepatology. 2018. doi:10.1002/hep.30251
[2] Estes C, Anstee QM, Arias-Loste MT, et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016-2030[J]. J Hepatol. 2018,69(4):896-904. doi:10.1016/j.jhep.2018.05.036
[3] Pang Y, Kartsonaki C, Turnbull I, et al. Diabetes, Plasma Glucose, and Incidence of Fatty Liver, Cirrhosis, and Liver Cancer: A Prospective Study of 0.5 Million People[J]. Hepatology. 2018,68(4):1308-1318. doi:10.1002/hep.30083
[4] Vilar-Gomez E, Calzadilla-Bertot L, Wai-Sun Wong V, et al. Fibrosis Severity as a Determinant of Cause-Specific Mortality in Patients With Advanced Nonalcoholic Fatty Liver Disease: A Multi-National Cohort Study[J]. Gastroenterology. 2018,155(2):443-457.e417. doi:10.1053/j.gastro.2018.04.034
[5] Liu X, Peng Y, Chen S, et al. An observational study on the association between major dietary patterns and non-alcoholic fatty liver disease in Chinese adolescents[J]. Medicine (Baltimore). 2018,97(17):e0576. doi:10.1097/md.0000000000010576
[6] Wong VW, Wong GL, Chan RS, et al. Beneficial effects of lifestyle intervention in non-obese patients with non-alcoholic fatty liver disease[J]. J Hepatol. 2018. doi:10.1016/j.jhep.2018.08.011
[7] Yan J, Yao B, Kuang H, et al. Liraglutide, sitagliptin and insulin glargine added to metformin: the effect on body weight and intrahepatic lipid in patients with type 2 diabetes mellitus and NAFLD[J]. Hepatology. 2018. doi:10.1002/hep.30320
[8] Wang S, Yan ZZ, Yang X, et al. Hepatocyte DUSP14 maintains metabolic homeostasis and suppresses inflammation in the liver[J]. Hepatology. 2018,67(4):1320-1338. doi:10.1002/hep.29616
[9] Ye P, Liu J, Xu W, et al. Dual-specificity Phosphatase 26 Protects Against Nonalcoholic Fatty Liver Disease in Mice through TAK1 Suppression[J]. Hepatology. 2018. doi:10.1002/hep.30485
[10] Ye P, Xiang M, Liao H, et al. Dual-Specificity Phosphatase 9 Protects Against Nonalcoholic Fatty Liver Disease in Mice Through ASK1 Suppression[J]. Hepatology. 2019,69(1):76-93. doi:10.1002/hep.30198
[11] Sun P, Zeng Q, Cheng D, et al. Caspase Recruitment Domain Protein 6 Protects Against Hepatic Steatosis and Insulin Resistance by Suppressing Apoptosis Signal-Regulating Kinase 1[J]. Hepatology. 2018,68(6):2212-2229. doi:10.1002/hep.30075
[12] Li M, Xu C, Shi J, et al. Fatty acids promote fatty liver disease via the dysregulation of 3-mercaptopyruvate sulfurtransferase/hydrogen sulfide pathway[J]. Gut. 2018,67(12):2169-2180. doi:10.1136/gutjnl-2017-313778
[13] Gong J, Fang C, Zhang P, et al. Tumor progression locus 2 in hepatocytes potentiates both liver and systemic metabolic disorders in mice[J]. Hepatology. 2018. doi:10.1002/hep.29820
[14] Liang D, Chen H, Zhao L, et al. Inhibition of EGFR attenuates fibrosis and stellate cell activation in diet-induced model of nonalcoholic fatty liver disease[J]. Biochim Biophys Acta Mol Basis Dis. 2018,1864(1):133-142. doi:10.1016/j.bbadis.2017.10.016
[15] Zhao Y, Gao L, Xu L, et al. Ubiquitin-specific protease 4 is an endogenous negative regulator of metabolic dysfunctions in nonalcoholic fatty liver disease[J]. Hepatology. 2018. doi:10.1002/hep.29889
[16] Luo P, Qin C, Zhu L, et al. Ubiquitin-Specific Peptidase 10 (USP10) Inhibits Hepatic Steatosis, Insulin Resistance, and Inflammation Through Sirt6[J]. Hepatology. 2018,68(5):1786-1803. doi:10.1002/hep.30062
[17] Lu Y, Jiang Z, Dai H, et al. Hepatic leukocyte immunoglobulin-like receptor B4 (LILRB4) attenuates nonalcoholic fatty liver disease via SHP1-TRAF6 pathway[J]. Hepatology. 2018,67(4):1303-1319. doi:10.1002/hep.29633
[18] Yu CJ, Wang QS, Wu MM, et al. TRUSS Exacerbates NAFLD Development by Promoting IkappaBalpha Degradation in Mice[J]. Hepatology. 2018,68(5):1769-1785. doi:10.1002/hep.30066
[19] Cai Y, Li H, Liu M, et al. Disruption of adenosine 2A receptor exacerbates NAFLD through increasing inflammatory responses and SREBP1c activity[J]. Hepatology. 2018,68(1):48-61. doi:10.1002/hep.29777
[20] Luo X, Li H, Ma L, et al. Expression of STING Is Increased in Liver Tissues From Patients With NAFLD and Promotes Macrophage-Mediated Hepatic Inflammation and Fibrosis in Mice[J]. Gastroenterology. 2018,155(6):1971-1984.e1974. doi:10.1053/j.gastro.2018.09.010
[21] Zhou H, Du W, Li Y, et al. Effects of melatonin on fatty liver disease: The role of NR4A1/DNA-PKcs/p53 pathway, mitochondrial fission, and mitophagy[J]. J Pineal Res. 2018,64(1). doi:10.1111/jpi.12450
[22] Guo J, Fang W, Sun L, et al. Ultraconserved element uc.372 drives hepatic lipid accumulation by suppressing miR-195/miR4668 maturation[J]. Nat Commun. 2018,9(1):612. doi:10.1038/s41467-018-03072-8
[23] Zhao XY, Xiong X, Liu T, et al. Long noncoding RNA licensing of obesity-linked hepatic lipogenesis and NAFLD pathogenesis[J]. Nat Commun. 2018,9(1):2986. doi:10.1038/s41467-018-05383-2
[24] Zhang T, Hu J, Wang X, et al. MicroRNA-378 promotes hepatic inflammation and fibrosis via modulation of the NF-kappaB-TNFalpha pathway[J]. J Hepatol. 2019,70(1):87-96. doi:10.1016/j.jhep.2018.08.026
[25] Zhang T, Duan J, Zhang L, et al. LXRalpha Promotes Hepatosteatosis in Part Through Activation of MicroRNA-378 Transcription and Inhibition of Ppargc1beta Expression[J]. Hepatology. 2018. doi:10.1002/hep.30301
[26] Liang JQ, Teoh N, Xu L, et al. Dietary cholesterol promotes steatohepatitis related hepatocellular carcinoma through dysregulated metabolism and calcium signaling[J]. Nat Commun. 2018,9(1):4490. doi:10.1038/s41467-018-06931-6
[27] Liu D, Wong CC, Fu L, et al. Squalene epoxidase drives NAFLD-induced hepatocellular carcinoma and is a pharmaceutical target[J]. Sci Transl Med. 2018,10(437). doi:10.1126/scitranslmed.aap9840
[28] Zhou D, Chen YW, Zhao ZH, et al. Sodium butyrate reduces high-fat diet-induced non-alcoholic steatohepatitis through upregulation of hepatic GLP-1R expression[J]. Exp Mol Med. 2018,50(12):157. doi:10.1038/s12276-018-0183-1
[29] Chen M, Hui S, Lang H, et al. SIRT3 Deficiency Promotes High-Fat Diet-Induced Nonalcoholic Fatty Liver Disease in Correlation with Impaired Intestinal Permeability through Gut Microbial Dysbiosis[J]. Mol Nutr Food Res. 2018:e1800612. doi:10.1002/mnfr.201800612
[30] Jiao N, Baker SS, Chapa-Rodriguez A, et al. Suppressed hepatic bile acid signalling despite elevated production of primary and secondary bile acids in NAFLD[J]. Gut. 2018,67(10):1881-1891. doi:10.1136/gutjnl-2017-314307
[31] Liu Y, Jiang L, Sun C, et al. Insulin/Snail1 axis ameliorates fatty liver disease by epigenetically suppressing lipogenesis[J]. Nat Commun. 2018,9(1):2751. doi:10.1038/s41467-018-05309-y
[32] Zhang P, Ge Z, Wang H, et al. Prolactin improves hepatic steatosis via CD36 pathway[J]. J Hepatol. 2018,68(6):1247-1255. doi:10.1016/j.jhep.2018.01.035
标签:
研究
脂肪肝
发表评论
全部评论
