轻微肝性脑病诊治:现状与进展,共识与争议
—— 作者: 时间:2017-10-12
阅读数:
761

阎明 崔瑞冰 山东大学齐鲁医院
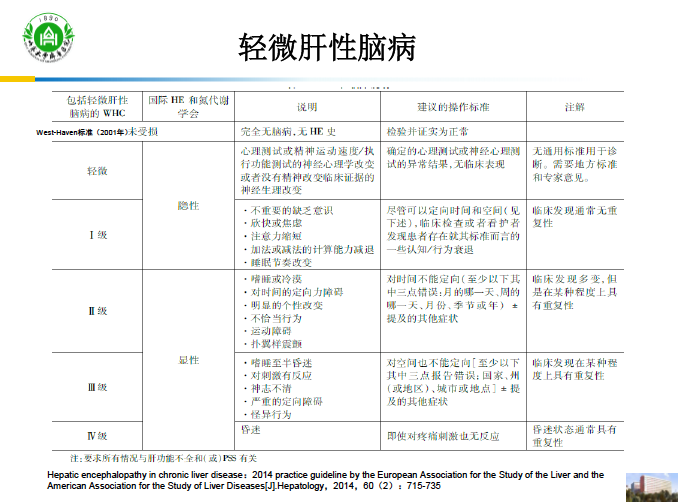
轻微肝性脑病(minimal hepatic encephalopathy,MHE)是指各种慢性肝病患者无明显脑病症状和生化异常,但用精细的智力试验或神经电生理等技术发现智力、神经、精神异常而诊断的脑病。国际肝性脑病与氮代谢学会(ISHEN)提出,肝性脑病的神经损害是一个连续性的过程,因MHE与临床肝性脑病第一期均表现为形似正常,但操作能力与应变能力减低而合并统称为隐匿性肝性脑病(covert hepatic encephalopathy,CHE),其他临床三期肝性脑病统称为显性肝性脑病(overt hepatic encephalopathy,OHE)[1]。如不进行有效治疗,部分MHE患者将在1年内智力进一步衰退,发展为显性肝性脑病。
MHE的诊断
目前,MHE诊断方法主要分为三大类:智能及神经心理学测验、神经电生理检测、脑部功能性成像检查。
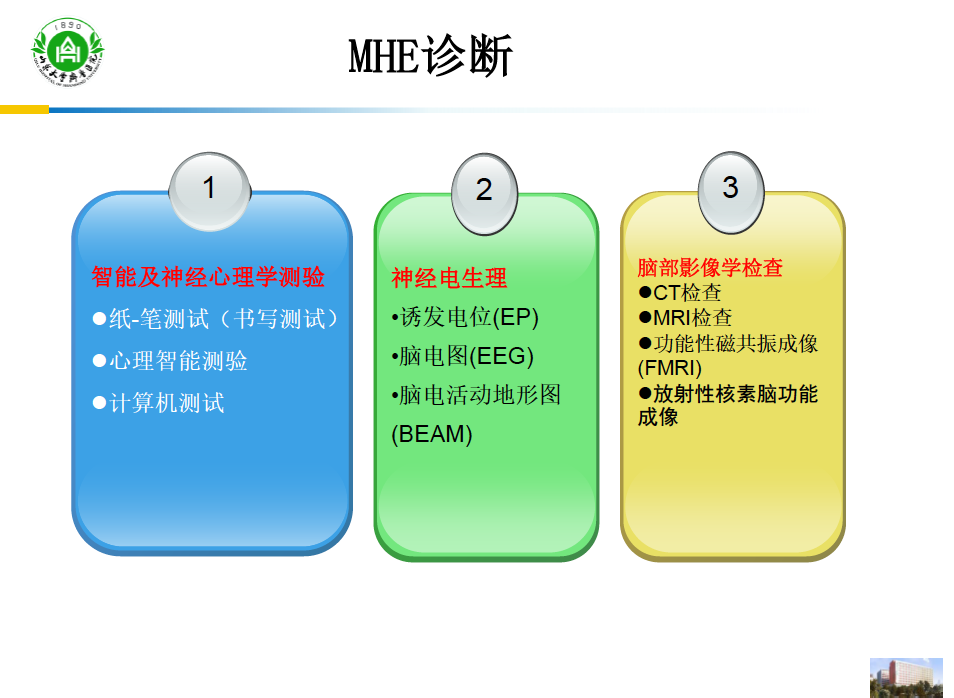
1.智能及神经心理学测验
①书写测试或纸-笔测试
书写测试或纸-笔测试又称肝性脑病心理测试评分(psychological hepatic encephalopathy score,PHES),主要由五个分测验组成:数字符号测验(digital symbol test,DST)、数字链接测验A(number connection test A,NCT-A)、数字链接测验B(number connection test B,NCT-B)、系列点测验(serial dotting test,SDT)和轨迹描绘或线追踪测验(line tracing test,LTT)。NCT-A、NCT-B主要评估精神集中、追踪和视觉运动速度;SDT主要评估精神运动速度;DST主要评估心理和视觉运动速度;LTT主要测试视觉运动和视觉空间技能[2-4]。
②计算机测试
计算机测试包括连续反应时间测验(continuous reaction time test,CRT)、抑制性控制测验(inhibitory control test,ICT)、斯特鲁测验(stroop test,ST)和临界闪烁频率测验(critical flicker frequency test,CFF)。主要测试患者的警觉性、反应能力、持续注意和记忆能力,间接地反映大脑胶质细胞肿胀、大脑皮层的神经活动、神经传导功能状态等[2]。
③心理智能测验
韦氏成人智力量表(WAIS):分为言语和操作两个量表,语言测试有常识、理解、算术、相似性、词汇及数字广度;操作方面包括数字符号、木块图、填图、图片排列及图像组合等。威斯康星卡片分类测试(WCST):分类卡片有4张主卡片和128张分类卡片。受试者按要求依次将分类卡片放在主卡片下,分类顺序为颜色、数量、形状。在完成3种形式分类后再重复一遍,共正确完成6次分类或已用完128张卡片而不能完成6次则测试结束。主要测量抽象分类、概念性思维能力。
2.神经电生理检测
①诱发电位(EP):包括视觉诱发电位、听觉诱发电位、躯体感觉诱发电位和事件相关电位。
EP是通过脑电分析仪测定由刺激引起的脑电位的变化。MHE的典型变化为潜伏期延长和峰值波幅下降。其结果相对客观,不受清醒或睡眠状态影响,不受教育程度和年龄的影响;但其仍可受听力、视觉等下降的影响[5]。
事件相关电位在1965年由美国科学家Sutton首次提出,反映的是接受刺激到出现认知加工的整个过程,故称之为认知电位,对MHE识别更具意义。
②脑电图(EEG)、脑电活动地形图(BEAM):对MHE识别较差,后者的频谱分析可检测到中峰频率明显降低。
3.脑部影像学检查
①CT和MRI
普通CT对MHE无特异。MRI常规检查可发现不同程度的脑皮质萎缩和脑水肿,并可出现双侧苍白球及壳核对称的T1加权信号增强,异常高信号可延至基底节区的其他结构和边缘系统或枕叶白质。
②脑功能与代谢成像检查:包括基于磁共振脑成像技术的脑功能与代谢成像检查(functional magnetic resonance imaging,FMRI)和基于放射性核素成像原理的脑功能成像检查,可在提供功能性定位成像的同时,进行形态学定位,通过了解相关部位物质的代谢状态,为诸多脑功能性疾病的认识和诊断提供依据[6]。
前者包括狭义FMRI,是根据脑功能活动区氧合血红蛋白含量变化而得到的血氧水平依赖性磁共振成像(BOLD-MRI),广义的FMR包含有磁共振波谱分析(MRS)、弥散张量成像(DTI)、弥散加权成像(DWI)、磁化传递成像(MTI)等技术;后者包括正电子核素发射断层扫描(PET-CT)和单光子发射断层扫描(SPECT)。
MHE诊断目前尚无“金标准”。神经心理学方法因其所用材料简单、方便易行而被临床尤其是我国医生广泛应用;但其结果可受年龄、受教育程度等因素影响。神经心理学、神经生理学和影像学三类方法建立的角度和神经学基础不同,检测结果的一致性尚存在差异,如FMRI显示MHE壳核血流与数字连接试验A呈正相关,但与数字符号试验则呈负相关。因此三类方法相互之间不能代替,仍需要进行综合评估。MHE的诊断首选神经心理学或神经生理学检查,提倡联合检测[7]。
轻微肝性脑病的治疗
1.一般治疗
MHE的一般治疗包括风险防控,去除诱因。
2.营养治疗
肝硬化患者中25%~80%存在营养不良。最新研究显示,营养治疗6个月后随访评估,MHE逆转明显好于对照组,肝脏Child-Turcotte-Pugh (CTP)评分、MELD评分、血氨、肌酐、白蛋白水平、PHES和CFF检测、中臂围、握力、骨骼肌群改善明显;疾病影响状态调查(SIP)、健康相关生活质量(HRQOL)明显好转[8]。
营养支持应以经肠营养(口入或鼻饲)为主。肝硬化时,鼓励少食多餐、全天均衡分布及晚间加餐。推荐适当给予多种维生素和必要的微量元素以促进肝脏修复[1,9]。
营养治疗的一般原则:总热量每天每千克理想体重30~40千卡。总热量中,碳水化合物供能一般应50%~60%以上;蛋白限制是过去常用的措施,目前已不再被推荐。蛋白质的摄入尚缺乏一致意见,一般为每天每千克理想体重1~1.5克。蛋白种类以植物蛋白为主,植物蛋白量因人而异,可达个体最大耐受量。
应根据患者理想体重、营养状态、肝脏储备功能状况等确定其营养方案;坚持医生指导、患者为主原则;这其中医生的指导是重要的。患者遵循以上原则,根据自己的食欲状况、消化吸收能力、饮食习惯及方式不断进行调节[10]。
3.药物治疗
降氨治疗目前仍是MHE药物治疗的首要选择,策略为预防血氨升高和降低已升高的血氨水平,具体措施包括酸化肠道、调节肠道微生态、清除幽门螺杆菌(HP)、降氨药物使用等。
①酸化肠道和调节肠道微生态
研究表明,乳果糖或利福昔明治疗后二者的MHE逆转率及6个月随访复发率无明显区别。益生菌或合生元对降低氨水平,逆转MHE和减少HE发生可有显著作用。
HP与MHE、HE关系存有争论。国内外不少研究显示HP可导致血氨升高,诱发MHE甚至OHE。但近年有文献报道,HP产生的氨的量不影响血氨水平,与MHE增加无关,故根除HP不会对肝硬化肝性脑病产生额外好处。但在预防胃十二指肠并发症和调节肠道菌群方面可能有益[11-14]。
②降氨药物的使用
L-鸟氨酸-L-门冬氨酸(LOLA)对OHE的治疗作用已广被证实,但对MHE的作用尚存异议。一个含有4项研究的荟萃分析显示,LOLA对MHE临床缓解率明显高于对照组,NCT-A反应时间明显缩短。我国的研究也显示了相似的结果。但也有研究认为,LOLA能够改善I、II期HE,而在MHE则未显示明显的效应[15,16]。
精氨酸偏酸性,对于伴有代谢性碱中毒者效果较好。但在肝功能极度低下、缺乏鸟氨酸循环代谢酶时,不易发挥脱氨作用,效果较差,限制了其临床应用。
近年研究显示,谷氨酸盐虽可降血氨,但形成的谷氨酰胺又可在肠道被谷氨酰胺酶分解成谷氨酸和氨,导致氨产生增加;且其不能透过血脑屏障,疗效欠佳,目前已很少推荐[17,18]。
③纠正血氨基酸谱紊乱
长期以来,氨基酸谱紊乱、假性神经递质学说是“氨中毒”外的HE第二大机制。有学者对经诱发电位诊断的MHE患者进行血清氨基酸谱分析发现:多种氨基酸明显异常,且支链/芳香族氨基酸(BCAA/AAA)明显降低;而此时血氨水平变化不明显。故推测氨基酸谱紊乱可能是MHE阶段的主要生化紊乱和产生MHE的重要原因,而其后血氨水平升高可能是OHE形成的主要因素[19]。
既往对BCAA降低终末期肝病进展和死亡风险的作用异议较大。近年认为,口服的BCAA营养物可用于治疗HE,通过增强骨骼肌除氨能力及促进谷氨酸前体α-酮戊二酸的产生来改善肝硬化患者的营养状态,改善MHE的神经心理学指标以及注意力、实用智力、汽车驾驶能力等,改善生活质量和肝硬化患者的预后。建议在应用BCAA时,同时应用α-酮戊二酸和(或)苯丁酸盐以抑制谷氨酰胺在肠道分解和(或)增加肾脏谷氨酰胺的排泄[20-25]。
④其他治疗
近期研究显示,治疗3个月,与乳果糖组相比,抗氧化剂(维生素A+维生素C+维生素E)+锌治疗可明显改善MHE,并显著降低动脉血氨水平、ALT、AST和CTP评分[26]。
有研究提示,炎症是MHE的发生和严重程度的重要因素,因此针对炎症治疗如N-甲基天冬氨酸拮抗剂、白细胞祛除术、促炎因子拮抗剂(如N-乙酰半胱氨酸、白蛋白)、抗炎药(环加氧酶抑制剂)有一定疗效;据报道神经递质调节药物如纳洛酮等对改善MHE也有一定效果;但以上药物的有效性和安全性尚有待更多研究加以证实[27,28]。
总 结
MHE是临床肝性脑病的前期,早期发现MHE对于逆转肝性脑病尤为重要。MHE的存在是一个动态过程,准确的诊断需要联合检测,综合评估。治疗需要动态的客观指标评估和治疗方案的个体化及调整。医生与MHE患者之间的交流、沟通与指导是必要且重要的。
专家简介
阎明
医学博士,山东大学齐鲁医院主任医师、教授、博士生导师,老年消化病科主任。被山东省卫生厅评为山东省卫生系统杰出学科带头人。先后兼任中华医学会肝病学分会常委、委员、自身免疫性肝病协作组副组长;中国医师协会消化医师分会常委;山东省医学会肝病学分会主任委员,山东省医师协会消化医师分会主任委员,山东省医学会消化分会、山东省中西医结合肝病学分会第一副主任委员等。Journal of Clinical and Translational Hepatology、World Journal of Gastroenterology、《中华肝脏病杂志》等十余种杂志编委、常务编委。
参考文献:
1.Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the European Association for the Study of the Liver and the American Association for the Study of Liver Diseases. Hepatology, 2014, 60(2): 715-735.
2.LauridsenMM, VilstrupH, et al. Diagnosing Covert Hepatic Encephalopathy. Clinical Liver Disease, 2015, 5(3): 71-74.
3.WeissenbornK, et al. Neuropsychological characterization of hepatic encephalopathy. Hepatology, 2001, 34: 768-773.
4.AmodioP,et al. Detection of minimal hepatic encephalopathy: normalization and optimization of the Psychometric Hepatic Encephalopathy Score. Aneuropsychological and quantified EEG study. Hepatology, 2008, 49: 346-53.
5.刘德山,阎明等,脑干听觉诱发电位检测对亚临床肝性脑病的诊断价值. 山东生物医学工程. 2004, 21(4): 36-37.
6.Krieger D, et al. Manganese and chronic hepatic encephalopathy. Lancet, 1995, 346(8970):270-274.
7.Hassan EA,et al. Minimal hepatic encephalopathy in patients with liver cirrhosis: Magnetic resonance spectroscopic brain findings versus neuropsychological changes. Arab Journal of Gastroenterology, 2014, 15: 108-113.
8.LalamaMA,et al. Nutrition, Fluid and Electrolytes in Chronic Liver Disease. Clinical liver disease, 2016, 7(1): 18-20.
9.MaharshiS,et al. Efficacy of Nutritional Therapy for Patients With Cirrhosis and Minimal Hepatic Encephalopathy in a Randomized Trial. Clinical Gastroenterology and Hepatology, 2016, 14: 454-460.
10.Nguyen DL, Morgan T. Protein restriction in hepatic encephalopathy is appropriate for selected patients: a point of view. Hepatology International, 2014, 8(2): 447-451.
11.Goyal O, et al. Minimal Hepatic Encephalopathy in Cirrhosis- How Long to Treat? Annals of Hepatology,2017,16 (1): 115-122.
12.Daniela VH, et al.The Effects of Probiotics and Symbiotics on Risk Factors for Hepatic Encephalopathy A Systematic Review. J ClinGastroenterol, 2017,51:312-323.
13.Abdel-HadyH,et al. Helicobacter pylori infection in hepatic encephalopathy: Relationship to plasma endotoxins and blood ammonia. Hepatology research, 2007, 37(12): 1026-1033.
14.Schulz C, et al. Prevalence of Helicobacter pylori Infection in Patients with Minimal Hepatic Encephalopathy. J Gastrointestin Liver Dis, 2016, 25(2): 191-195.
15.Jiang Q,et al. L-Ornithine-L-aspartate in the management of hepatic encephalopathy: A meta-analysis. Journal of Gastroenterology and Hepatology, 2009, 24(1): 9-14.
16.李瑜元. 门冬氨酸鸟氨酸治疗显性和轻微型肝性脑病. 临床肝胆病杂志,2011,27(1):100-102.
17.LembergA,FernándezMA. Hepatic encephalopathy, ammonia, glutamate, glutamine and oxidative stress. Annals of Hepatology, 2009, 8(2): 95-102.
18.汤习良,胡莉,盛瑞玲.精氨酸对肝硬化与重症型肝炎中肝性脑病的疗效观察.中华现代内科杂志,2006,3(5):580-581.
19.阎明,赵宪村,等.亚临床型肝性脑病的血清氨基酸谱分析.中华肝脏病杂志,1998,6(2):116.
20.MarchesiniG,et al. Nutritional supplementation with branched-chain amino acids in advanced cirrhosis: a double-blind, randomized trial[J]. Gastroenterology, 2003, 124(7): 1792-1801.
21.Als-Nielsen B,et al. Branched-chain amino acids for hepatic encephalopathy. The Cochrane database of systematic reviews, 2003, 2: CD001939.
22.Dam G,et al. Branched-chain amino acids increase arterial blood ammonia in spite of enhanced intrinsic muscle ammonia metabolism in patients with cirrhosis and healthy subjects. American journal of physiology. Gastrointestinal and liver physiology, 2011, 301(2): G269-G277.
23.Dam G,et al. Branched-chain amino acids and muscle ammonia detoxification in cirrhosis. Metabolic brain disease, 2013, 28(2): 217-220.
24.Les I,et al. Effects of branched-chain aminoacids supplementation in patients with cirrhosis and a previous episode of hepatic encephalopathy: a randomized study. The American journal of gastroenterology, 2011, 106(6): 1081-1088.
25.Holecek M. Branched-chain amino acids and ammonia metabolism in liver disease: Therapeutic implications. Nutrition, 2013, 29(10): 1186-1191.
26.Mousa N, et al. The role of antioxidants and zinc in minimal hepatic encephalopathy: a randomized trial. TherAdvGastroenterol 2016, 9(5): 684-691.
27.Seyan AS,et al .Changing face of hepatic encephalopathy: role of inflammation and oxidative stress. World journal of gastroenterology, 2010, 16(27): 3347-3357.
28.王国栋,等. 纳洛酮乳果糖治疗肝硬化轻微肝性脑病对照分析.中国实用医药,2012,7(34):123-124.
标签:
循证视点
肝性脑病
发表评论
全部评论
